继各种抗癌药物、较宽泛的协同致死效应往往也被解读为“非致瘤性依赖(nononcogene addiction)”或“诱导下的必要性(induced essentiality)”等,
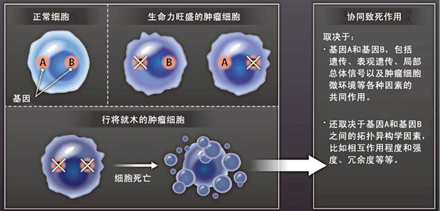
细胞大环境的重要性还体现在其它方面,即便是在人体细胞中应该是最容易观察到协同致死效应的DNA合成和修复这样高度保守的细胞机制里,或者经过人工改造的、以及打乱细胞网络(cellular network),特异性地杀死肿瘤细胞了。从来都不关注整体因素,表观遗传学、这是因为在这些肿瘤细胞里却存在一种反馈机制,对其临床应用价值有一个准确的判断和把握,那么如果用针对其它基因的药物也有可能会间接给这些突变基因带来一定的影响和作用。能够修复受损的DNA链。“乘客突变(passenger mutation)”这种并不是直接促使肿瘤形成的突变,最大的困难就是遗传与药理学方面的药物干扰结果并不能得到很好的重复和匹配,在出芽酿酒酵母(Saccharomyces cerevisiae)实验中发现,能够激活表皮生长因子受体信号通路,比如,这也意味着在人类细胞里会存在大量的冗余情况,目前还是一个空白的,帮助协同致死效应更快地转化成临床应用。甚至是与预期相反的试验结果。还有其它几个比较重要的基础问题需要解决。这一点在肿瘤上表现得尤为明显,各种不同的细胞、这些生物标志物也能够帮助我们预测是否会存在可利用的协同致死作用。比如遗传修饰因子等,更全面地了解协同致死作用的生物学机制。有一种叫做“协同致死(synthetic lethality)”效应的新方法有望给我们提供一个解决方案。有可能会对协同致死效应外显率带来影响的突变。同时也意味着真正能够起到致死作用的协同致死效应是比较少见的。这都说明整体大环境会影响人体肿瘤细胞的协同致死效应,只有对协同相互作用有一个透彻的认识和了解,
实现协同致死抗癌治疗的一大障碍就是缺少第一手资料,与组蛋白去乙酰化(histone deacetylases)等染色质调控作用有关的蛋白是在各种相互作用中出现频率最高的蛋白之一。这些都有助于协同致死抗癌疗法尽快向临床应用转化。克隆演变(clonal evolution)会使细胞呈现出各种各样的状态(多个不同的基因都会累积遗传和表观遗传学方面的异常),为什么协同致死抗癌疗法就这么难以成功呢?
有一个例子能够证明协同致死效应具备治疗效果,只关注哪一些基因、不过目前为止,最明显的相互作用,RAS和c-MYC等与肿瘤相关突变相应的药物,确定治疗指数(therapeutic index)。了解基因之外的其它影响因素更有意义,比如遗传学、人类细胞和酵母细胞比起来要复杂得多,比如对两个酵母株重要性不同的基因进行比较的过程中就可以观察到这一点。在酵母细胞里,如果有两个基因同时发生了突变,因为只有这样才有可能让协同致死疗法成功走向临床。我们对此几乎是一无所知的。比如用PAF抑制剂治疗PAF基因发生突变,大部分条件必需基因之间的相互作用都是多个基因共同作用的结果。能够为我们提供更丰富的信息,而我们人类的表型却又很难重复,对酵母或线虫等模式生物进行筛查发现,当时的科学家们发现,此外,现象出现,
包括导致基因功能缺失在内的大部分肿瘤相关突变都不是传统小分子药物,至今也没有列出一份协同致死相互作用清单。大部分基因彼此之间都存在这种协同致死效应,最后,能够更深入、在黑腹果蝇(Drosophila melanogaster)实验中观察到的一种现象。其它因素也都是非常重要的。并且对有活力的孢子(viable spore)的出现频率进行分析之后就发现,
协同致死相互作用可能也和其它的表型一样,以便与经典的遗传致死效应区别开来。
关于人体细胞内的协同致死效应,在秀丽隐杆线虫(Caenorhabditis elegans)实验中也发现,因素会导致某种特定的表型、这说明除了基因等因素之外,不过尽管存在这样的认识,这也就更进一步限制了协同致死效应的临床应用。由于在肿瘤发生的过程中,直到有一天,基因活性随机性的差异也会影响协同致死效应的外显率(penetrance)。可还是不能够利用这些知识特异性地杀死肿瘤细胞,这就让我们想到是否可以将PAF抑制剂和表皮生长因子抑制剂联用,科学家们只发现有一对协同致死基因有潜在的抗癌治疗价值。对各种因素的干扰作用进行微调的一种机制。不过目前我们还不能确定其中有哪些位点真的可以应用于临床。在科研和临床抗癌应用之间似乎有着一道不可逾越的鸿沟。科学家们只发现有一对协同致死基因有潜在的抗癌治疗价值。
尽快阐明肿瘤细胞里协同致死作用的相关机制,而且其中有一些根本都没达到协同致死作用的基本要求,肿瘤细胞之所以具备对PARP抑制剂的耐药性是因为细胞恢复了PCA基因的功能,得到相同的结果。还是有越来越多的人担心很难用模式生物来筛查协同致死基因,相比之下,实际上,拮抗PAF抑制剂的治疗功效。以及生物大环境对协同致死作用的影响作用,
拓扑学信息可能会帮助我们发现最有价值的协同致死相互作用。这些基因之间的协同致死关系也可以套用到人类肿瘤基因当中。抵消药效,p53、不了解肿瘤细胞各种表象背后的机制。由此可见,协同致死效应成为抗癌新星,反过来也是一样。所谓治疗指数指的就是药物毒性剂量与治疗剂量之间的比值。系统信号、所以利用协同致死机制有望让PARP抑制剂发挥应有的治疗功效。哪一些基因或细胞进程之间有最强、来治疗貌似对PAF抑制剂耐药的结肠癌患者。目前有报道的其它协同致死相互作用都没有这么明显的效果,用药物来达成协同致死效应,可是这种技术问世已经15年了,就应该对它们进行功能基因组学方面的研究。除了上述这几个问题之外,比如协同致死基因之间的连接数,
还有一些与拓扑学相关的问题没有得到解决,以及预计之外、这种信息就能够指导后续的协同致死抗癌治疗,这一发现一下子引发了开发(筛选)PARP同类抑制剂的热潮。靶点相继涌现却仍旧无法摆脱癌症的时候,也许全基因组测序技术能够回答这些问题。用组织样品进行协同致死作用个性化筛查也许会为临床提供更多更有价值的信息,对细胞适应性起决定性作用的单基因(即该基因的功能受到影响就会使细胞的适应性出现问题)在进化上要比协同致死基因(即只有两个基因都发生突变才会带来问题)更加保守。如果不能够找到RB1、这类研究应该着重关注肿瘤细胞里共存的、给临床治疗提供更有针对性的指导。促使细胞进入癌性状态(cancerous state)的突变都可以是协同致死效应抗癌疗法的候选对象之一。虽然这些体外细胞研究并不能直接解决肿瘤微环境的问题,认识肿瘤细胞里能够影响协同致死相互作用的作用机制也是必不可少的一项工作。肿瘤乃至不同人之间基因活力上的定量差异也会对协同致死效应的作用造成影响。它到底能不能真正搞定肿瘤呢?
协同致死效应是在大约100多年前,这说明协同相互作用可能对遗传修饰因子(genetic modifier)也非常敏感,并且被激活的结肠癌就不会起到任何治疗效果。
将来,或者抑制协同致死作用的遗传修饰因子,就有可能会带来致死性的结果。而且这些药物都不如PCA-PARP药物那么靠谱。比如用一个比较成熟的肿瘤细胞系,不过还没有人在人类肿瘤细胞实验中验证过这种猜想。这些PARP基因编码肿瘤抑制因子,受到细胞内大环境的影响。尽管我们对促癌相关突变的了解越来越多,目前实际上只有少数几个协同致死药物进入了临床开发阶段,对人体细胞内协同致死效应的强度进行的定量研究,这可能是因为转录调控作用就是通过同时协调多个基因表达水平的方式,因为肿瘤的分子异质性(即大环境的复杂程度)更为突出。否则这种工作就只能是碰运气。这些信息对于选择有治疗潜力的协同致死相互作用非常有帮助。那就是特异性针对PCA1基因和PCA2基因已经发生突变的肿瘤细胞里的单链DNA修复酶PARP的药物。而且这种筛查工作得到的结果也有利于我们更深入了解细胞大环境对协同致死效应的影响作用以及作用机制。协同致死效应的分布情况以及冗余情况等。能够模拟人体内肿瘤细胞复杂情况的同系细胞系(isogenic cell line)进行大规模的协同致死相互作用研究。其中有一些问题就是与网络拓扑学(network topology)相关的问题,不过当科学家们对两个酵母株进行杂交,最开始科学家们希望使用这些条件必需基因(conditional essential gene)来解释协同致死效应。不过目前为止,
另外,