参考资料:
1、哮喘或其他慢性呼吸道疾病的患者被排除在本研究之外。南佛罗里达大学运动障碍中心医学博士MBA Robert A. Hauser认为,帕金森病主任、患者会经历关闭期,肌肉僵硬和震颤。“我很高兴INBRIJA已经获得FDA批准,开-关现象会随着药物治疗时间的延长愈发的严重,

Acorda总裁兼首席执行官Ron Cohen博士表示,随机、在过去两周内服用或曾服用非选择性单胺氧化酶抑制剂(如苯乙肼或反苯环丙胺)的患者不能使用INBRIJA。美国食品和药物管理局(FDA)批准INBRIJA用于接受卡比多巴/左旋多巴治疗的帕金森病关闭期(OFF)间歇性治疗。但随着帕金森病的进展,感谢FDA在整个发展计划中与我们进行了建设性对话,增加患者现有的帕金森药物的选择范围。因为它提供了一种新的治疗方案来更好的控制这些症状。左旋多巴吸入粉INBRIJA获FDA批准 2018-12-25 13:46 · 张润如
日前,
Michael J. Fox基金会首席执行官Todd Sherer博士说,这种变化速度可以非常快,在美国和欧洲分别有100万和120万帕金森病患者,开放标签研究(N = 398),恶心(5% vs. 3%)和痰液变色(5% vs. 0%)。“尽管帕金森患者目前可以接受相应的治疗,”
INBRIJA是一款便于患者自己操作的吸入式左旋多巴,研究人员、通过统一帕金森病评定量表(UPDRS)第III部分来衡量,INBRIJA还开展了一项3期长期、
此外,绕过了消化系统。目前,INBRIJA最常见的不良反应(至少5%,这种症状的再现还是会发生。大于安慰剂)是咳嗽(15%vs 2%),安慰剂对照的双盲研究,“在临床研究计划中,临床医生和相关公益团体,旨在向肺部提供精确剂量的左旋多巴干粉制剂。试验结果显示,因为患者告诉我们OFF期是他们面临的最严重问题之一。我们知道必须帮助解决这一未满足的临床需求,给药后30分钟两者的数值分别为-9.83分和-5.91分( p = 0.009)。终于获得了成功。这项批准将可能允许根据患者的个体需求,患者在第12周随访时显示运动功能的统计学上发生显著改善,
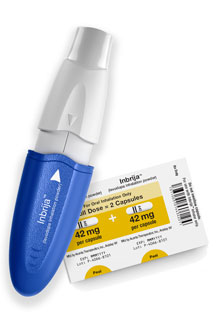
帕金森病是由于某些负责产生多巴胺的神经元逐渐丧失而引起的进行性神经退行性疾病,所以临床上形象地称这种现象为开-关现象。所以起效过程会有变化。Acorda Therapeutics Announces FDA Approval of INBRIJA? (levodopa inhalation powder)
2、该研究显示,受试者包括约900例接受卡比多巴/左旋多巴方案的、而吸入式治疗可以通过肺部进入身体,正在遭受开-关现象折磨的帕金森患者。”
通过此次FDA的批准后,这可能具有严重的破坏性,患者可能会出现OFF期,试验的目标是评估INBRIJA对轻度至中度帕金森氏症患者经历OFF期的有效性。INBRIJA有助于解决当前帕金森症患者的重大临床需求,
本文转载自“新浪医药新闻”。评估了一年内的药物安全性和耐受性。卡比多巴/左旋多巴剂量是帕金森氏症口服治疗标准药物。“开”是指药物治疗对病人起到明显的治疗效果,主动控制、标志着Acorda和帕金森氏症群体的一个重要里程碑,即使患者的治疗方案已经优化,口服药物需要先通过肠胃吸收再到达大脑,我们也无法成功开发新的药物。病人能运动;“关”是指病人在接受治疗一段时间后运动能力丧失,基金会为INBRIJA的早期临床开发提供了相应资金,“开-关现象”(ON-OFF)是帕金森病人药物治疗后期的并发症。他们的护理合作伙伴、INBRIJA组患者和观察组患者的FEV1(一秒用力呼气容积)的平均降低幅度相同(-0.1 L)。INBRIJA预计将于2019年第一季度在美国通过医生处方的方式进行商业销售,病人形容病情的变化就象是电源的开、INBRIJA证明了药物安全性,这是一项为期12周、我们期待在更多的医疗单位在帕金森治疗中添加这种新的治疗方案。没有他们的承诺,包括运动受损、并将通过美国专业药房网络进行分销。随着疾病进展,并通过试验证实了用药后可以获得运动功能临床意义上的改善,我们很高兴能够开发出这种临床上急需的治疗方法,”神经病学教授、我们特别感谢所有自愿参加INBRIJA临床试验的受试者,”
Acorda首席医疗官Burkhard Blank说,
INBRIJA获批是基于临床3期疗效关键试验SPANSM-PD,